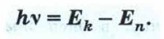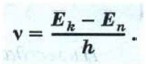|
|
|
|
|
Глава 3. Электромагнитное поле § 51. Поглощение и испускание света атомами. Происхождение линейчатых спектров
В процессе изучения и применения линейчатых спектров возникли различные вопросы. Как, например, объяснить, почему атомы каждого химического элемента имеют свой строго индивидуальный набор спектральных линий? Почему совпадают линии излучения и поглощения в спектре данного элемента? Чем обусловлены различия в спектрах атомов разных элементов? Ответы на эти и многие другие вопросы удалось найти только в начале XX в. благодаря возникновению новой физической теории — квантовой механики. Одним из основоположников этой теории был датский физик Нильс Бор. Бор пришёл к заключению, что свет излучается атомами вещества. В связи с этим в 1913 г. он сформулировал два постулата.
Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны. Номера стационарных орбит и энергетических уровней (начиная с первого) в общем случае обозначаются латинскими буквами: n, k и т. д. Радиусы орбит, как и энергии стационарных состояний, могут принимать не любые, а определённые дискретные значения. Первая орбита расположена ближе всех к ядру.
Согласно закону сохранения энергии, энергия излучённого фотона равна разности энергий стационарных состояний:
Из этого уравнения следует, что атом может излучать свет только с частотами
Атом может также поглощать фотоны. При поглощении фотона атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией. Состояние атома, в котором все электроны находятся на стационарных орбитах с наименьшей возможной энергией, называется основным. Все другие состояния атома называются возбуждёнными. У атомов каждого химического элемента имеется свой характерный набор энергетических уровней. Поэтому переходу с более высокого энергетического уровня на более низкий будут соответствовать характерные линии в спектре испускания, отличные от линий в спектре другого элемента. Совпадение линий излучения и поглощения в спектрах атомов данного химического элемента объясняется тем, что частоты волн, соответствующих этим линиям в спектре, определяются одними и теми же энергетическими уровнями. Поэтому атомы могут поглощать свет только тех частот, которые они способны излучать. Вопросы1. Сформулируйте постулаты Бора.
ЗаданиеВ вашем распоряжении имеются две стальные спицы. Придумайте эксперименты, с помощью которых можно было бы определить: а) намагничена ли одна из спиц, и если да, то какая; б) намагничены ли обе спицы. П р и м е ч а н и е: в эксперименте могут быть использованы только указанные предметы.
|
|
|